Молекулярная масса
Одной из важнейших физико-химической характеристикой любого высокомолекулярного соединения является его молекулярная масса.
Точное название этой величины - относительная молекулярная масса полимера. Она определяется как средняя величина от относительных молекулярных масс полимерных молекул. Правилами номенклатуры Международного союза теоретической и прикладной химии ИЮПАК (IUPAC) разрешается применять в том числе обозначение «молекулярный вес».
Числовое значение молекулярной массы полимеров определяется с одной стороны видом молекулярно-массового распределения в нем и с другой стороны - способом числового усреднения. В зависимости от этого способа определены главные типы молекулярных масс, а именно среднечисловая (Mn), среднемассовая (Мw) и средневязкостная (Мв) молекулярная масса. На сегодняшний день не принято метода, который может однозначно показать значения Mn и Mw во всем интервале молекулярных масс полимеров. Поэтому ученые используют различные методы, охватывающие лишь некоторые интервалы значений молекулярных масс.
Значение молекулярной массы определяет важнейшие свойства полимеров и пути их переработки в изделия, в том числе вторичной. Например, при росте молекулярной массы критически изменяются свойства полимеров, причем при достижении определенных предельных значений высоких молекулярных масс свойства могут полностью меняться. Например, простейший полимерполиэтилен при низких молекулярных массах имеет свойства близкие к твердым парафинам (полиэтиленовый воск). Такой полимер легко течет и в расплавленном виде ведет себя аналогично жидкостям. При повышении молекулярной массы полиэтилен приобретает больше вязких свойств и перерабатывается последовательно методами литья под давлением, выдувного формования, экструзии, прессования и т.д. Наконец, полиэтилен, обладающий очень большими значениями молекулярных (в несколько миллионов) масс полимера, так называемый сверхвысокомолекулярный полиэтилен (СПМПЭ) практически не способен к плавлению и вязкому течению, а его переработка крайне затруднена.
Таким образом, наблюдается существенный рост вязкости расплава и раствора полимеров при повышении их молекулярной массы. Этот процесс делает их переработку затрудненной. Считается, что наиболее удобные для переработки значения молекулярная масса составляют для полиэтилена от 100 000 до 300 000, для полистирола от 300 000 до 400 000, для полиформальдегида (ПОМ) от 40 000 до 150 000 атомных единиц массы.
Условно, марки одно и того же полимера, но с разной молекулярной массой принято делить по перерабатываемости на «экструзионные», «выдувные», «литьевые» и т.д. Однако нельзя забывать, что в состав каждой марки могут входить разнообразные присадки, регулирующие свойства полимерного материала. Также на свойства марок влияет метод получения высокомолекулярного соединения и использующиеся при этом химикаты. Кроме того, современные марки редко бывают линейными полимерами в чистом виде, обычно они содержат разветвленные цепи и сополимерные звенья в том или ином количестве.
Определение молекулярных масс полимеров
В зависимости от того, какая методика применяется, или какая характеристика полимера измеряется, получаются разные средние молекулярные массы.
Среднечисловую молекулярную массу Мn можно получить в любом экспериментальном методе, который позволяет определить общее число молекул полимера в растворе независимо от их размеров и, следовательно, массы.
Мы знаем, что свойства растворов, определяемые только числом растворенных частиц и не зависящие от их природы, называются коллигативными свойствами. К ним относится понижение температуры замерзания раствора, повышение его температуры кипения, осмотическое давление и давление пара растворителя над раствором. Все эти характеристики растворов полимеров связаны со среднечисловой молекулярной массой.
Криоскопия
Понижение температуры затвердевания раствора полимера в сравнении с температурой замерзания чистого растворителя описывается уравнением:
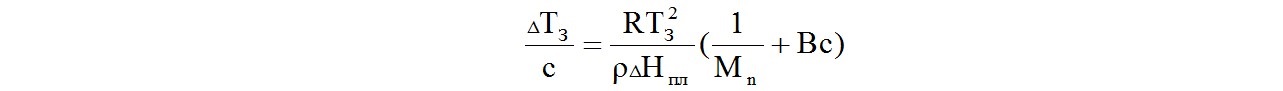
где: ΔТз - депрессия температуры замерзания, т.е. разница между температурами замерзания чистого растворителя и раствора полимера;
с - концентрация полимера в растворе в г/л;
R - универсальная газовая постоянная;
Тз - температура замерзания чистого растворителя;
ρ - плотность растворителя, г/л;
ΔНпл - удельная энтальпия плавления растворителя Дж/г;
Мn - среднечисловая молекулярная масса полимера;
В - второй вириальный коэффициент.
Второй вириальный коэффициент В является постоянной для данного раствора величиной, поправкой, учитывающей отклонения свойств реального полимерного раствора от свойств идеальных растворов. Если считать раствор предельно разбавленным, то при концентрации, стремящейся к нулю, раствор можно считать идеальным и второй вириальный коэффициент не учитывать. Тогда уравнение примет вид:
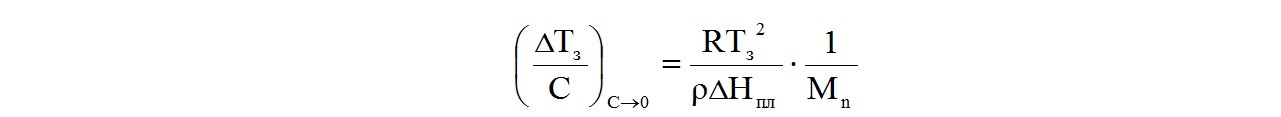
В методе криоскопии этим уравнением пользуются так. Готовят ряд растворов полимеров известной концентрации и определяют их температуры замерзания. В тех же условиях и с помощью того же термометра определяют температуру замерзания чистого растворителя. Находят депрессию температуры замерзания ΔТз каждого раствора с концентрацией С и строят график зависимости температурной депрессии от концентрации полимера в растворах:
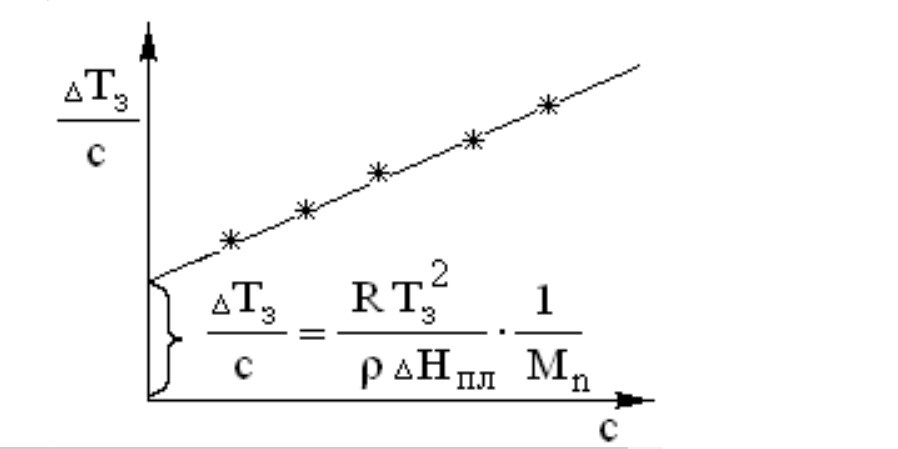
Определение среднечисловой молекулярной массы полимера методом криоскопии
Поскольку приведенное выше уравнение является уравнением прямой вида y=ax, экспериментальные точки на графике ложатся на прямую. Экстраполяцией этой прямой к началу координат (к нулевой концентрации полимера) получают отрезок по оси ординат, который в выбранном масштабе графика равен величине, обратной среднечисловой молекулярной массе, умноженной на дробь, содержащую только постоянные величины, относящиеся к растворителю.
Зная величину отрезка по оси Y на графике и физические константы растворителя, вычисляют среднечисловую молекулярную массу полимера Mn.
Эбуллиоскопия
В методе эбуллиоскопии замеряют повышение температуры кипения растворов полимеров различной концентрации по отношению к температуре кипения растворителя ∆Ткип.
Основное уравнение, связывающее ∆Ткип, концентрацию полимера в растворе С и его среднечисловую молекулярную массу, выглядит аналогично предыдущему:
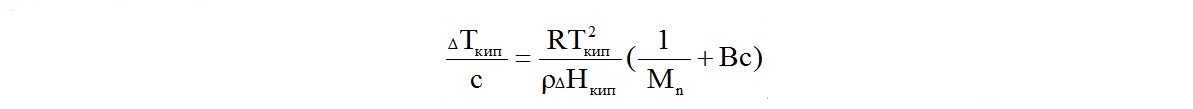
Вместо температуры замерзания растворителя в нем фигурирует температура его кипения Ткип , а вместо энтальпии плавления - энтальпия кипения.
Как и в уравнении криоскопии, В - второй вириальный коэффициент, величина, учитывающая отклонение свойств реальных растворов от идеального. В области предельно разбавленных растворов с концентрацией полимера, стремящейся к нулю, вторым вириальным коэффициентом можно пренебречь, и привести уравнение к линейному виду.
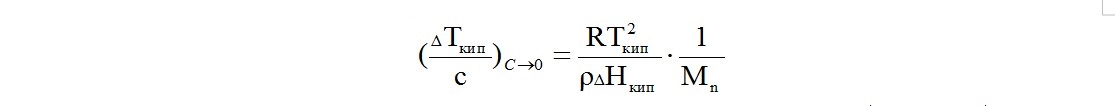
Строя, как и в методе криоскопии, график зависимости (∆Ткип /С) от С и экстраполируя экспериментальную прямую до пересечения с осью ординат, находят по графику величину, равную правой части этого уравнения. Поскольку первая дробь в правой части уравнения содержит только постоянные величины, характеризующие растворитель, вычислить Мn не составляет труда.
Общим недостатком методов является необходимость измерения очень малых изменений температур (≈0,0010). Точность метода падает пропорционально росту Мn. Поэтому эти методы применимы при величине среднечисловой молекулярной массы полимеров не более 30000.
Мембранная осмометрия
Этот метод основан на измерении осмотического давления растворов.
Если раствор и чистый растворитель разделены полупроницаемой мембраной, то из-за разности химических потенциалов растворителя в растворе и чистого растворителя молекулы растворителя диффундируют в раствор, стремясь довести его до практически бесконечного разбавления.
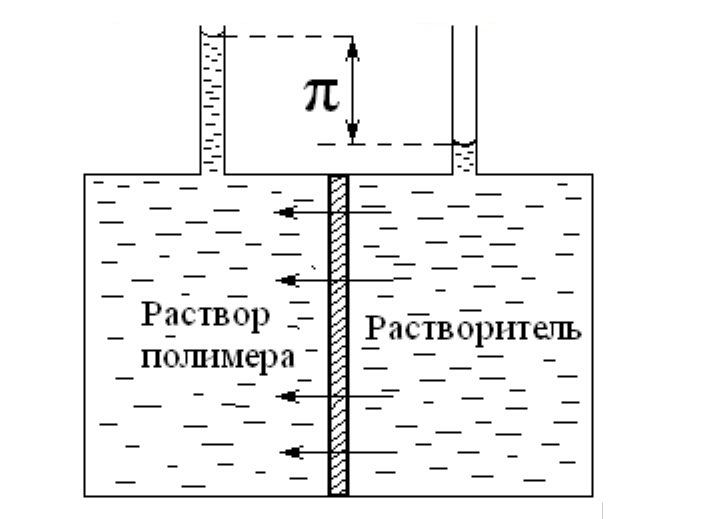
Определение осмотического давления полимерных растворов
Поток растворителя можно остановить, приложив определенное давление со стороны раствора. Это давление равно осмотическому давлению раствора.
В осмометрах статического равновесия измеряют уровень поднятия жидкости в капилляре. Это гидростатическое давление и равно осмотическому. Метод весьма точен и конструктивно очень прост (разъемная камера с двумя капиллярами и мембраной между половинками камеры осмометра).
Основной его недостаток - малая скорость диффузии растворителя. Поэтому наступление равновесия приходится ждать несколько часов или даже дней.
В динамических осмометрах мембрана в измерительной ячейке расположена горизонтально: поверх мембраны наливают раствор, нижняя часть ячейки заполнена растворителем. При диффузии растворителя в раствор пузырек воздуха в капилляре 1 увлекается током растворителя и приходит в движение. Это движение фиксируется оптическим датчиком 3 и подается на усилитель 4, который командует двигателем 5, поднимающим или опускающим резервуар с растворителем 6. Движение резервуара регулирует гидростатическое давление, пока диффузия растворителя не прекратится. По перемещению резервуара определяют величину осмотического давления.
Основное преимущество динамического осмометра - равновесие устанавливается за 5-7 минут.
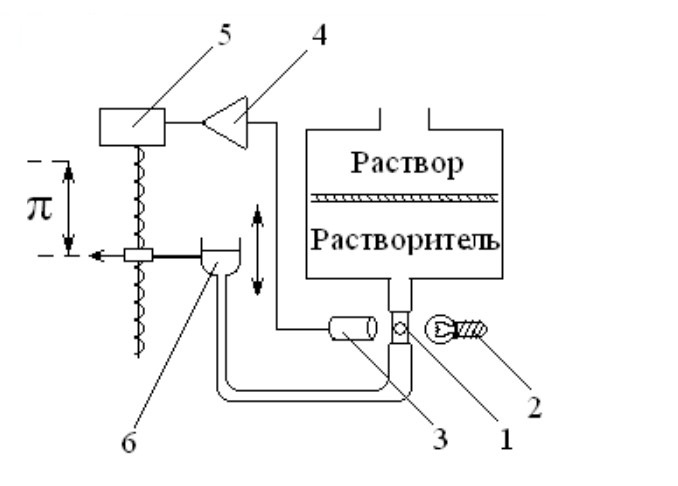
Схема осмометра динамического действия
1 - пузырек воздуха;
2 - осветитель;
3 - оптический датчик;
4 - усилитель,
5 - электродвигатель;
6 - резервуар с растворителем.
Осмотическое давление полимерного раствора связано со среднечисловой молекулярной массой полимера соотношением:
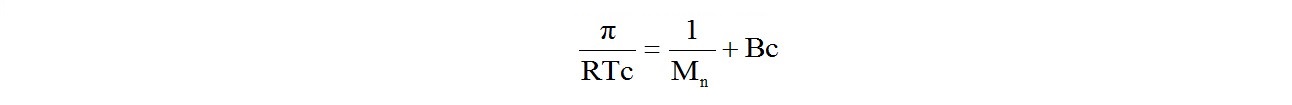
где п - осмотическое давление;
R - универсальная газовая постоянная;
Т - температура раствора;
с - концентрация полимера в растворе;
В - второй вириальный коэффициент.
Из вида уравнения следует, что зависимость (π/RTc) от с является линейной и графически представляется прямой линией.
Нанося экспериментальные точки на график и экстраполируя полученную прямую до пересечения с осью ординат, избавляются от второго вириального коэффициента и приводят уравнение к виду
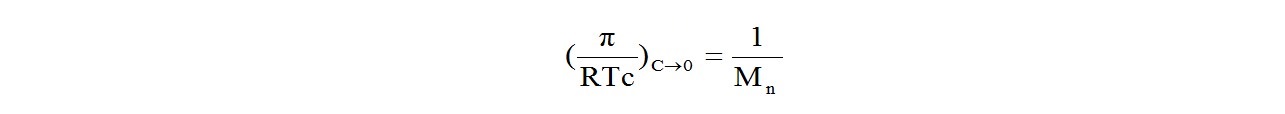
Точка пересечения прямой с осью ординат дает отрезок, равный 1/Мn, откуда находят и саму среднечисловую молекулярную массу полимера.
Ограничение метода мембранной осмометрии - в качестве мембран. Полностью односторонне проницаемых мембран не существует, поэтому полимер тоже проходит через мембрану навстречу растворителю. Чем меньше молекулярная масса полимера, тем легче происходит диффузия его молекул навстречу молекулам растворителя. Поэтому метод применим в диапазоне Мn от 30 тыс. до 1 млн.
Парофазная осмометрия
Известно, что при постоянной температуре давление пара растворителя над раствором меньше, чем над чистым растворителем. Поэтому капля чистого растворителя и капля раствора, помещенного в атмосферу насыщенного пара растворителя, ведут себя по-разному. Жидкий чистый растворитель находится в равновесии со своим насыщенным паром. Над каплей раствора давление пара выше равновесного, поэтому на поверхности капли начинается конденсация растворителя из паровой фазы. При этом выделяется теплота конденсации ∆Н, и температура капли повышается на величину ∆Т. Эти параметры связаны простым соотношением:
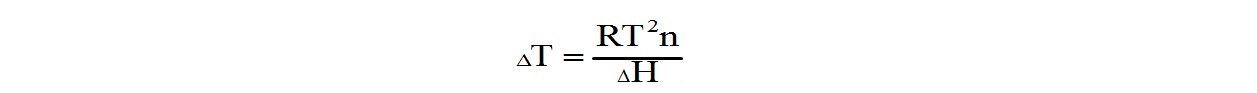
где R - универсальная газовая постоянная;
Т - температура растворителя;
n - мольная доля полимера в растворе.
Температуру капель раствора и растворителя фиксируют точными термисторами, которые преобразуют температуру в величину электрического напряжения. Таким образом, в опыте практически определяют напряжение рассогласования ∆U, которое связано с молекулярной массой Мn полимера:
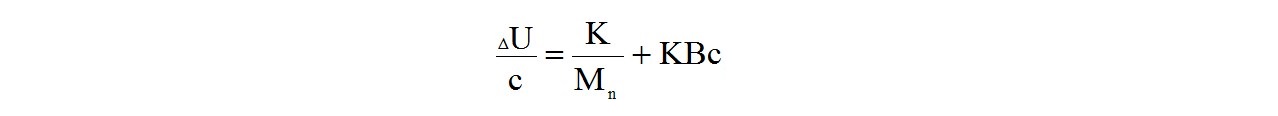
где К - калибровочный коэффициент термисторной пары. Его находят по стандартным образцам полимеров с известной молекулярной массой Мn:
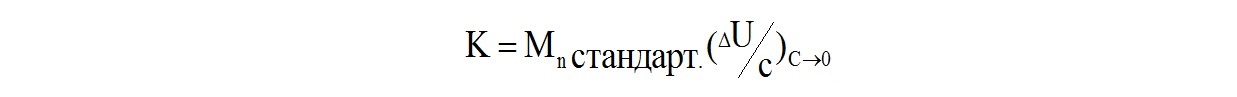
Метод парофазной осмометрии применим для анализа полимеров со среднечисловой молекулярной массой до 30000, но гораздо точнее криоскопии и эбуллиоскопии.
Вискозиметрия
Вязкость даже разбавленных растворов полимера существенно выше вязкости растворителя. Увеличение вязкости является прямой функцией размеров молекул полимера, т.е. его молекулярной массы. Молекулярная масса Mv и вязкость раствора полимера связаны уравнением Марка-Хаувика:
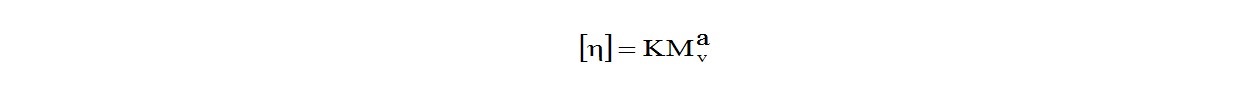
Здесь К и а - константы, зависящие от системы полимер-растворитель и от температуры. Они определены для большого числа полимеров и растворителей.
В вискозиметрии используют известное уравнение Гагена-Пуазейля. Время τ протекания раствора объемом V через капилляр радиуса r и длиной l зависит от его абсолютной вязкости η.
Для раствора и чистого растворителя можно записать:
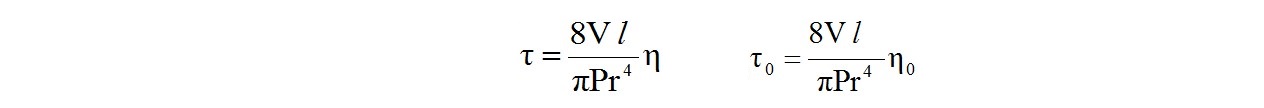
где Р - давление, под которым происходит течение жидкости.
Отсюда для одних и тех же условий течения жидкости получаем:
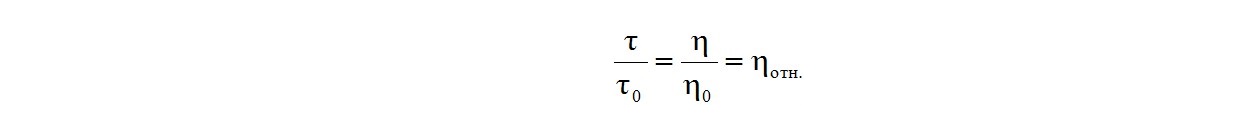
Относительная вязкость ηотн. полимерного раствора связана с его характеристической вязкостью соотношением:
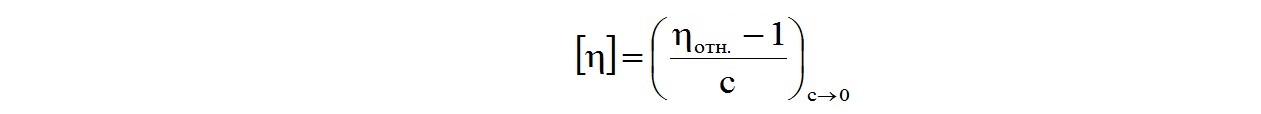
Следовательно, характеристическую вязкость, а стало быть, и вязкостную молекулярную массу полимера можно найти, зная время истечения полимерного раствора и чистого растворителя через один и тот же капилляр одного и того же вискозиметра.
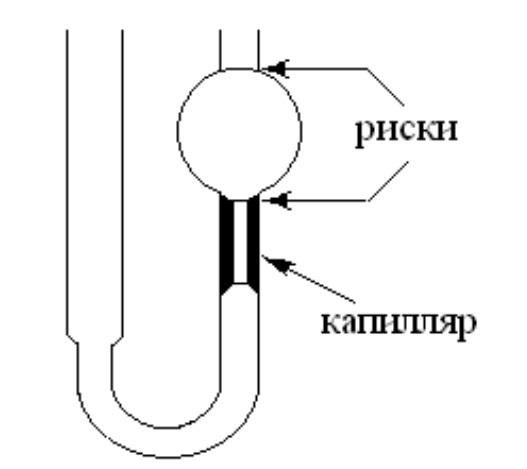
Вискозиметр - это U-образная трубка с капилляром определенной длины и сечения и находящимся над ним баллоном определенного объема. Правое колено вискозиметра заполняют жидкостью и дают ей свободно перетекать в левое колено, засекая по секундомеру время, за которое уровень жидкости опустится от верхней до нижней риски.
Вискозиметрия - самый простой и удобный метод определения молекулярной массы полимера. Важно лишь, чтобы все растворы в момент определения их вязкости имели одинаковую температуру с точностью ±0,010, не содержали механических примесей, а вискозиметр стоял строго вертикально.
Ультрацентрифугирование
Из всех методов определения молекулярных масс полимеров этот является, пожалуй, самым сложным и трудоемким. Мы рассмотрим один, наиболее простой его вариант, метод седиментационного равновесия.
При вращении пробирки с раствором полимера в центрифуге сила седиментации (центробежная) стремится прижать молекулы полимера к дну пробирки, а диффузионно-энтропийный фактор стремится распределить молекулы по всему объему раствора. При постоянной скорости вращения со временем (несколько дней) достигается равновесие этих факторов, и концентрация полимера закономерно меняется от поверхности раствора в его глубину к дну пробирки. Z-среднюю молекулярную массу вычисляют по уравнению:
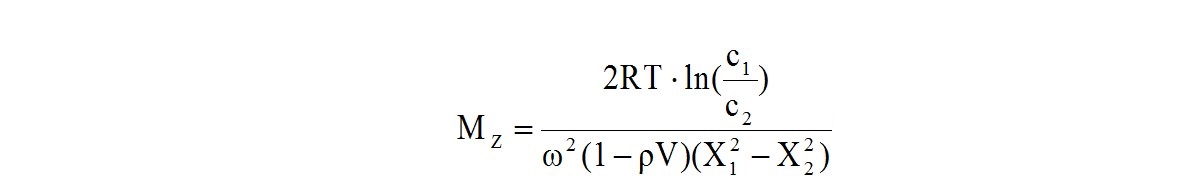
где с1 и с2 - концентрация полимера в растворе на расстоянии Х1 и Х2 от оси вращения (обычно у поверхности раствора в пробирке и у ее дна);
ω - угловая скорость вращения;
ρ - плотность растворителя;
V - удельный объем полимера в растворе;
R - универсальная газовая постоянная;
Т - температура раствора.
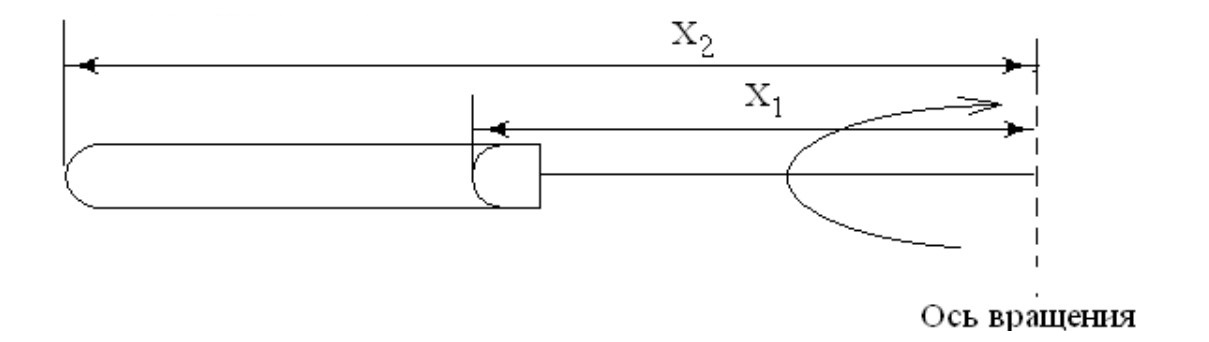
Концентрации с1 и с2 обычно определяют по показателю преломления раствора после центрифугирования, отбирая пробы раствора с поверхности и со дна пробирки с помощью шприца.
Светорассеяние
Известно, что если луч света проходит через оптически прозрачную среду, содержащую посторонние частицы, часть его энергии рассеивается во все стороны. Именно этим обусловлено появление радуги после дождя, синий цвет неба, красный цвет восходов и закатов, голубизна моря и т.д.
Светорассеяние используется для измерения среднемассовой молекулярной массы полимеров МW. Она связана с интенсивностью рассеянного света, проходящего через полимерный раствор, уравнением Дебая:
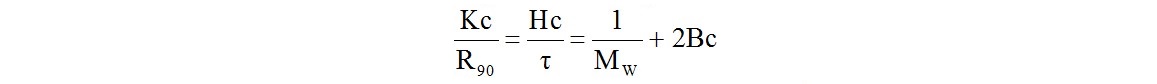
где В - второй вириальный коэффициент;
с - концентрация полимера в растворе;
R90 - так называемое отношение Рэлея при угле наблюдения 900;
τ - мутность среды, возникающая при светорассеянии;
К или Н - константы, зависящие от показателя преломления растворителя и длины волны падающего света.
Обычно R90 или τ определяют с помощью нефелометра, а К или Н с помощью дифференциального рефрактометра. Для определения МW надо знать показатель преломления растворителя и раствора и концентрацию раствора.
Метод применим в диапазоне молекулярных масс от 10 тыс. до 10 млн. Главное требование к проведению измерения среднемассовой молекулярной массы - полное обеспыливание растворов, так как любая пылинка вызовет светорассеяние во много раз большее, чем молекулы полимера.

